
- 11 janv. 2026
- Élise Marivaux
- 12
Les brevets des médicaments ne expirent pas tous le même jour, même s’ils ont tous un terme de base de 20 ans. Ce chiffre, souvent cité, est trompeur. Il ne représente pas la durée réelle pendant laquelle un médicament est protégé sur le marché. En réalité, la plupart des médicaments ne bénéficient que de 7 à 12 ans d’exclusivité commerciale réelle - bien moins que les 20 ans annoncés. Pourquoi ? Parce que la clock du brevet commence à tourner dès le dépôt de la demande, bien avant que le médicament ne soit même testé sur des humains.
Le brevet de 20 ans : une horloge qui démarre trop tôt
En vertu de la loi américaine (35 U.S.C. § 154(a)(2)) et des accords internationaux comme l’Accord TRIPS, le brevet d’un médicament a une durée légale de 20 ans à compter de la date de dépôt de la demande. Mais cette date tombe souvent 10 à 15 ans avant que le médicament ne soit approuvé par la FDA. Pourquoi ? Parce que la recherche, les essais cliniques en phases I, II et III, et la préparation des dossiers de demande d’autorisation prennent du temps. En moyenne, il faut 10 à 12 ans pour qu’un médicament passe du laboratoire au marché. Cela signifie que le brevet a déjà perdu la moitié de sa durée avant même que le laboratoire ne commence à vendre le produit.
Imaginez que vous investissez 2,3 milliards de dollars dans un médicament - c’est le coût moyen de développement selon PhRMA - et que vous n’avez que 8 ans pour le rentabiliser. C’est la réalité pour la plupart des laboratoires. C’est pourquoi ils utilisent des mécanismes légaux pour rattraper ce temps perdu.
Les prolongations de brevet : comment les laboratoires gagnent du temps
La loi Hatch-Waxman de 1984 a créé un outil crucial : l’extension de terme de brevet (PTE). Elle permet d’ajouter jusqu’à 5 ans supplémentaires à la durée du brevet, mais avec une condition : la durée totale d’exclusivité ne peut pas dépasser 14 ans après l’approbation de la FDA. Ce n’est pas une simple prolongation : c’est un calcul complexe. Le laboratoire doit déposer sa demande d’extension dans les 60 jours suivant l’approbation de la FDA. Si elle rate ce délai, elle perd le droit à l’extension - et avec elle, des milliards de revenus.
En plus de cette extension, il existe des ajustements de terme de brevet (PTA) pour compenser les retards de l’USPTO. Si l’office met plus de 14 mois pour envoyer la première réponse à la demande, ou plus de 3 ans pour délivrer le brevet, le laboratoire reçoit des jours supplémentaires. Ces ajustements peuvent ajouter des mois, voire des années, à la protection. Par exemple, le médicament Spinraza (nusinersen) bénéficie d’une protection jusqu’en 2030 grâce à une combinaison de plusieurs brevets et ajustements.
Les exclusivités réglementaires : une protection en plus
Le brevet n’est pas la seule barrière à l’entrée des génériques. La FDA accorde aussi des périodes d’exclusivité réglementaire, indépendantes du brevet. Elles empêchent les fabricants de génériques de déposer leur demande, même si le brevet a expiré.
- Exclusivité de nouvelle entité chimique (NCE) : 5 ans. Pendant cette période, la FDA ne peut pas accepter une demande de générique basée sur les données du laboratoire original.
- Exclusivité pédiatrique : 6 mois supplémentaires si le laboratoire réalise des études sur les enfants, comme demandé par la FDA.
- Exclusivité des médicaments orphelins : 7 ans pour les traitements de maladies rares (moins de 200 000 patients aux États-Unis).
- Exclusivité pour nouvelles indications : 3 ans si le laboratoire ajoute une nouvelle utilisation ou une nouvelle posologie, avec de nouvelles études cliniques.
Ces périodes peuvent se cumuler. Un médicament peut avoir un brevet qui expire en 2027, mais rester protégé jusqu’en 2030 à cause de l’exclusivité pédiatrique. C’est ce qui s’est produit avec le médicament Eliquis (apixaban) : même après l’expiration du brevet principal, la protection réglementaire a retardé l’entrée des génériques.

Le phénomène du « patent cliff » : quand les revenus s’effondrent
Le « patent cliff » est le moment critique où un médicament perd sa protection. C’est une chute brutale des revenus. Selon les données du National Bureau of Economic Research, les prix des médicaments administrés par un médecin chutent de 38 % à 48 % après l’expiration du brevet. Pour les médicaments pris par voie orale, la baisse peut atteindre 60 % à 80 % en un an.
En décembre 2022, après l’expiration du brevet d’Eliquis, les génériques ont capté 35 % du marché en six mois. Un an plus tard, ils représentaient plus de 60 % des ventes. Les prix ont chuté de 62 %. Ce scénario se répète pour chaque grand médicament. En 2025, les pertes de revenus mondiales dues aux expirations de brevets atteindront 62 milliards de dollars, selon Evaluate Pharma - le pic de la vague de « patent cliff ».
Les laboratoires savent que ce moment arrive. C’est pourquoi 78 % d’entre eux utilisent des stratégies de gestion du cycle de vie du produit. Ils modifient la formule, changent le mode d’administration (par exemple, passer d’une injection à une pilule), ou ajoutent un diagnostic associé. AstraZeneca a prolongé la protection de Tagrisso (osimertinib) jusqu’en 2033 en combinant plusieurs brevets sur des formulations et des usages secondaires - même si le brevet principal sur la molécule expire en 2026.
Les pièges et les abus : l’« evergreening »
Il existe un débat éthique autour des « stratégies d’evergreening ». Certains laboratoires déposent des brevets secondaires sur des détails mineurs : un nouveau sel, une nouvelle forme de comprimé, un emballage différent. Ces brevets n’améliorent pas la sécurité ou l’efficacité du médicament, mais ils bloquent les génériques.
Le Federal Trade Commission (FTC) a documenté dans son rapport de 2021 que ces pratiques peuvent retarder l’entrée des génériques de 2 à 3 ans. Par exemple, une entreprise peut déposer un brevet sur un dispositif d’injection, puis lancer une version « améliorée » du médicament avec ce dispositif - même si la molécule est la même. Cela crée de la confusion chez les patients et les médecins, et maintient les prix élevés.
Les génériques ne sont pas passifs. Les fabricants de génériques lancent des défis juridiques via des certificats de type IV (paragraph IV) pour contester la validité des brevets. Si le brevet est annulé, le premier générique obtient 180 jours d’exclusivité - un gros avantage commercial. Ce système crée une bataille juridique permanente, avec des procédures qui durent en moyenne 37 mois.
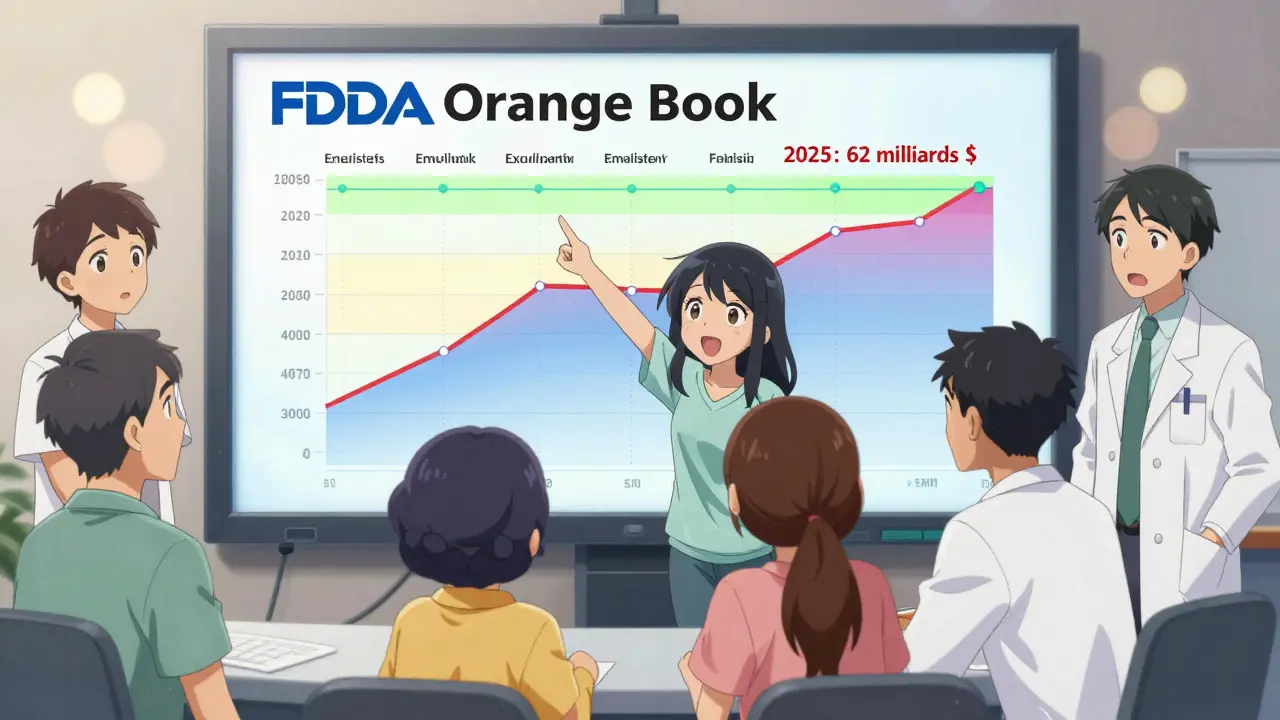
Comment savoir quand un médicament va expirer ?
Pour trouver la date exacte d’expiration d’un médicament, il faut consulter le Orange Book de la FDA. C’est le seul registre officiel qui liste les brevets et les exclusivités associés à chaque médicament approuvé. 98,7 % des laboratoires y déclarent leurs brevets dans les 30 jours suivant l’approbation.
Les outils comme DrugPatentWatch ou LexisNexis PatentSight permettent d’analyser les portefeuilles de brevets en détail. Ils montrent non seulement la date de dépôt, mais aussi les extensions, les ajustements, les litiges en cours et les brevets secondaires. Pour un pharmacien, un médecin ou un patient, comprendre ces dates permet de prévoir quand un médicament deviendra moins cher.
En France, les brevets suivent les mêmes règles de l’OMPI, mais la négociation des prix et l’entrée des génériques se font différemment. Le système de remboursement et de fixation des prix par la Sécurité sociale influence aussi le moment où les génériques prennent le dessus - souvent plus rapidement qu’aux États-Unis.
Le futur : des brevets plus courts ?
La pression augmente pour réduire la durée des brevets. L’OMS recommande de passer à 15 ans pour améliorer l’accès aux médicaments. En parallèle, un projet de loi américain, le « Restoring the America Invents Act », propose de supprimer certains ajustements de brevet - ce qui réduirait la protection de 6 à 9 mois en moyenne.
Les laboratoires résistent. Ils affirment que 20 ans avec extensions sont nécessaires pour récupérer les coûts de recherche. Mais les données montrent que 80 % des revenus d’un médicament sont générés dans les 5 premières années après son lancement. Le vrai problème n’est pas la durée du brevet, mais la concentration des profits dans une courte fenêtre, et la complexité des systèmes qui la prolongent artificiellement.
Le futur des médicaments coûteux ne dépendra pas seulement de la loi, mais de la transparence. Plus les patients et les systèmes de santé connaissent les dates réelles d’expiration, plus ils peuvent négocier, anticiper, et choisir. La clé n’est pas de supprimer les brevets - c’est de les rendre lisibles, équitables, et alignés avec la santé publique.
Un brevet de médicament expire-t-il toujours après 20 ans ?
Non. Le brevet a une durée légale de 20 ans à compter de sa date de dépôt, mais la protection réelle sur le marché est souvent plus courte - entre 7 et 12 ans - à cause du temps nécessaire pour développer et approuver le médicament. Des extensions légales, comme l’extension de terme de brevet (PTE) ou l’exclusivité réglementaire, peuvent prolonger cette protection jusqu’à 14 ans après l’approbation de la FDA.
Qu’est-ce que le « patent cliff » ?
Le « patent cliff » est le moment où un médicament perd sa protection par brevet, ce qui permet l’entrée de génériques. À ce moment, les prix chutent de 38 % à 80 % en quelques mois. Les laboratoires perdent des milliards de revenus en un an. C’est un événement majeur pour les marchés pharmaceutiques, avec des pics comme celui de 2025, où 62 milliards de dollars de revenus seront perdus à cause de plusieurs expirations simultanées.
Les génériques peuvent-ils entrer dès l’expiration du brevet ?
Pas toujours. Même si le brevet expire, d’autres barrières peuvent bloquer l’entrée des génériques : l’exclusivité réglementaire (5 ans pour une nouvelle entité chimique, 7 ans pour un médicament orphelin, 6 mois pour des études pédiatriques), ou des litiges en cours. Si un fabricant de génériques conteste un brevet par un certificat de type IV, la FDA peut être bloquée pendant 30 mois si le laboratoire original intente un procès.
Comment savoir si un médicament va bientôt devenir générique ?
Consultez le Orange Book de la FDA, qui liste tous les brevets et exclusivités associés à chaque médicament approuvé. Des outils comme DrugPatentWatch ou LexisNexis PatentSight permettent aussi de suivre les dates d’expiration, les extensions et les litiges en cours. Pour les patients, les pharmacies ou les assureurs, ces informations aident à anticiper les baisses de prix.
Pourquoi certains médicaments restent-ils chers même après l’expiration du brevet ?
Parce que les génériques ne sont pas toujours disponibles immédiatement - à cause de litiges ou d’exclusivités réglementaires. Même après leur arrivée, certains systèmes de remboursement ou d’assurance imposent des coûts de copaiement élevés pour les génériques, ou favorisent les versions « similaires » du médicament original. Parfois, les laboratoires lancent des versions « reformulées » avec un nouveau brevet, ce qui maintient les prix élevés.
Les brevets sur les biologiques (biosimilaires) expirent-ils comme les médicaments classiques ?
Non. Les biologiques (comme Humira ou Enbrel) sont plus complexes à reproduire. Ils bénéficient d’une exclusivité de 12 ans aux États-Unis, contre 5 ans pour les médicaments chimiques. Même après l’expiration du brevet, les biosimilaires mettent plus de temps à se développer - en moyenne, ils atteignent 40 à 60 % du marché, contre 80 à 95 % pour les génériques classiques.
Le système des brevets pharmaceutiques est un équilibre fragile entre innovation et accès. Il n’est pas parfait, mais il est compréhensible - à condition de connaître ses règles. Savoir quand un médicament va devenir générique, ce n’est pas juste une question de droit. C’est une question de santé publique, de budget, et d’équité.

12 Commentaires
Encore une histoire de laboratoires qui trichent avec la loi pour garder les prix à 1000€ la boîte... C'est scandaleux, et vous savez quoi ? On s'en fout, tant que les gens continuent à payer.
Et oui, je parle de vous, les riches qui croient que la santé est un luxe.
Donc en résumé : 20 ans de brevet = 8 ans de vraie protection, et le reste c’est du bricolage juridique avec des points-virgules et des sous-mariniers de l’USPTO 😅
Et on s’étonne que les gens prennent des génériques en Chine...
Je veux bien croire que c’est complexe, mais c’est pas un jeu de société, c’est la vie des gens.
Je trouve ce sujet profondément fascinant, et je tiens à remercier l’auteur pour cette analyse rigoureuse, qui met en lumière une réalité souvent méconnue du grand public.
Il est essentiel, en effet, de comprendre que le brevet pharmaceutique n’est pas un simple mécanisme de protection, mais un équilibre délicat entre innovation, investissement, et accès à la santé.
Les extensions légales, les exclusivités réglementaires, les ajustements de terme - tout cela forme un tissu complexe, mais nécessaire, pour encourager la recherche.
Je suis particulièrement impressionné par la mention du « patent cliff » et les chiffres de l’NBER - ils illustrent parfaitement la volatilité du marché.
Il est également crucial de noter que les systèmes de remboursement en France, bien que différents, n’échappent pas à cette logique.
La transparence, comme vous le soulignez, est la clé - et le Orange Book, malgré son nom, est un outil précieux.
Je me demande si une campagne d’éducation publique, menée par les médecins et les pharmaciens, ne serait pas la prochaine étape logique.
Les patients doivent savoir que « générique » ne signifie pas « moins bon » - c’est une question d’éducation, de confiance, et de culture.
Je suis convaincu que, dans dix ans, nous regarderons en arrière avec étonnement à cette époque où les prix des médicaments étaient aussi opaques.
Encore merci - c’est des articles comme celui-ci qui rendent Internet utile.
Je viens de regarder le prix de mon traitement pour le cholestérol... 120€ par mois.
Et je me dis : si je peux le faire en générique, pourquoi j’attends ?
Le système est cassé, mais moi je vais pas me laisser faire.
Je vais changer de pharmacie et demander le générique dès demain.
Et si ils refusent, je leur dis : « c’est pas mon problème, c’est le vôtre ».
La vie est un processus long
La science aussi
Les brevets sont des outils
Les humains sont plus que des chiffres
Et pourtant…
On oublie souvent ça
Les labos ils sont des voleurs et les politiques ils sont des cons
Fin de la discussion
Je trouve intéressant que vous mentionniez les 14 ans d’exclusivité après l’approbation - c’est une donnée cruciale que tout le monde oublie.
Le vrai problème, c’est pas la durée du brevet, c’est que les laboratoires ont appris à jouer avec les règles comme des enfants avec un jeu vidéo.
Et on s’étonne que les gens se méfient des médicaments ?
On leur demande de faire confiance à un système qui les trompe depuis 30 ans.
Je ne dis pas qu’il faut supprimer les brevets - je dis qu’il faut les rendre transparents, pas un roman policier avec 17 chapitres.
Je suis d’accord avec vous, mais il faut aussi dire que les génériques, parfois, c’est pas la même chose…
Je connais un gars qui a eu des effets secondaires avec un générique de son anticoagulant…
Et puis, vous savez, la qualité…
Je ne dis pas qu’il faut tout garder cher, mais il faut faire attention.
Le système est conçu pour que les riches restent riches et que les pauvres meurent lentement.
Les brevets sont une illusion de progrès.
La science est publique, les profits sont privés.
Les laboratoires ne sont pas des chercheurs, ils sont des banquiers avec des labos.
Et le fait que vous trouviez ça normal…
C’est ça le vrai problème.
Vous savez qui contrôle les brevets ? Les États-Unis.
Et qui contrôle les États-Unis ? Les banques.
Et qui contrôle les banques ? Les mêmes qui financent les campagnes électorales.
Et qui décide de la santé des Français ?
Les Américains.
Le brevet de 20 ans ? C’est un piège pour nous, les Européens.
On nous fait croire que c’est de la science, mais c’est de la guerre économique.
Et vous, vous lisez le Orange Book ?
Vous croyez que c’est gratuit ?
Non. C’est payant.
Et qui paie ?
Nous.
Le système est corrompu de l’intérieur.
Je viens de partager cet article avec ma mère qui prend un traitement depuis 10 ans 🥹
Elle a pleuré en apprenant qu’elle aurait pu payer 10x moins…
On a besoin de plus de transparence, pas de plus de brevets.
Je suis tellement fière de vous pour ce travail 💪❤️
On peut faire mieux. On doit faire mieux.
Je ne savais pas que les génériques pouvaient être bloqués par des choses comme des études pédiatriques…
Je pensais que c’était juste une question de brevet.
Je me sens un peu naif maintenant.
Mais merci de m’avoir appris ça.
Je vais regarder le Orange Book demain.
Je veux comprendre.
Et je veux aider.